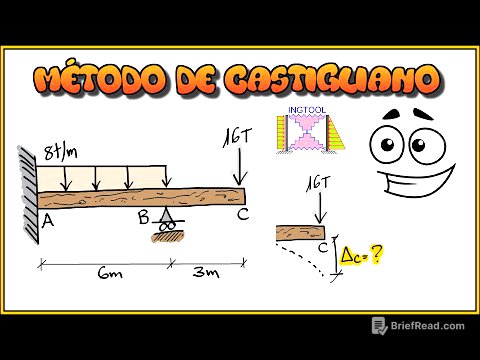
Breve Resumen
Este video explica la cinética química, que es el estudio de la velocidad de las reacciones químicas. Se discuten los factores que influyen en estas velocidades, incluyendo la energía de activación, la temperatura, la presión, la concentración, el tamaño de las partículas, la luz y los catalizadores (incluyendo los biocatalizadores).
- La velocidad de las reacciones químicas puede ser modificada por diversos factores.
- Los catalizadores, incluyendo los biocatalizadores, juegan un papel crucial en la aceleración o retardo de estas reacciones.
Cinética química [0:00]
La cinética química es el estudio de la velocidad a la que se producen las reacciones químicas. Todas las reacciones químicas requieren una energía de activación, que es la energía mínima necesaria para que la reacción comience. Durante las reacciones, las partículas chocan entre sí, formando nuevos enlaces.
Energía de activación [0:13]
La energía de activación es la energía necesaria para que una reacción química pueda iniciar. Es un umbral que debe superarse para que los reactivos se transformen en productos.
Colisión de partículas [0:20]
Durante una reacción química, las partículas de los reactivos colisionan entre sí. Estas colisiones son necesarias para romper los enlaces existentes y formar nuevos enlaces, lo que lleva a la formación de los productos.
Factores que influyen en la velocidad de las reacciones químicas [0:27]
La velocidad de las reacciones químicas puede ser influenciada por varios factores. Estos factores incluyen la temperatura, la presión, la concentración de los reactivos, el tamaño de las partículas, la presencia de luz y la presencia de catalizadores.
Temperatura [0:42]
Al aumentar la temperatura, las partículas se mueven más rápido, lo que resulta en más colisiones y, por lo tanto, una reacción química más rápida. Por el contrario, al disminuir la temperatura, el movimiento de las partículas se ralentiza, disminuyendo las colisiones y ralentizando la reacción.
Presión [1:03]
A mayor presión, hay más movimiento de partículas y, por lo tanto, más colisiones, lo que acelera la reacción. A menor presión, el movimiento y las colisiones de las partículas disminuyen, lo que ralentiza la reacción.
Concentración [1:18]
Una mayor concentración de reactivos significa que hay más partículas presentes, lo que resulta en más colisiones y una reacción química más rápida. Una menor concentración conduce a menos colisiones y una reacción más lenta.
Tamaño de partículas [1:33]
Si un reactivo es un sólido, cuanto más fragmentado o molido esté, más rápido se llevará a cabo la reacción. Esto se debe a que un tamaño de partícula más pequeño incrementa la superficie de contacto entre las partículas, lo que resulta en más colisiones. Un sólido más grande tiene una menor superficie de contacto y, por lo tanto, una reacción más lenta.
Luz [2:00]
La luz es una forma de energía, y algunas reacciones se producen más rápido cuando se iluminan. Esto se debe a que algunas sustancias son más sensibles a la luz. Es por esta razón que los laboratorios utilizan botellas de vidrio color ámbar para proteger las sustancias químicas de la luz.
Catalizadores [2:17]
Los catalizadores son sustancias que influyen en la energía de activación, acelerando o retardando la velocidad de las reacciones químicas, pero no participan en ellas. En la industria alimenticia, por ejemplo, se utilizan catalizadores para acelerar la obtención de margarina o como conservadores para retardar el deterioro de los alimentos.
Biocatalizadores [2:44]
Los biocatalizadores son catalizadores fabricados por seres vivos. Un ejemplo es la nitrogenasa, producida por ciertas bacterias, que ayuda a acelerar la transformación del nitrógeno atmosférico en sustancias que las plantas pueden absorber y utilizar.
![💥Factores que afectan la velocidad de una Reacción Química💥| Cinética Química | [Fácil y Rápido]](https://wm-img.halpindev.com/p-briefread_c-10_b-10/urlb/aHR0cDovL2ltZy55b3V0dWJlLmNvbS92aS9KMGo2MVBfb2s1WS9tYXhyZXNkZWZhdWx0LmpwZw==.jpg)





![La GUÍA DEFINITIVA para APRENDER a DERIVAR [En 10 minutos⏰]](https://wm-img.halpindev.com/p-briefread_c-10_b-10/urlb/aHR0cDovL2ltZy55b3V0dWJlLmNvbS92aS80aGx0cURXLXlDQS9ocWRlZmF1bHQuanBn.jpg)