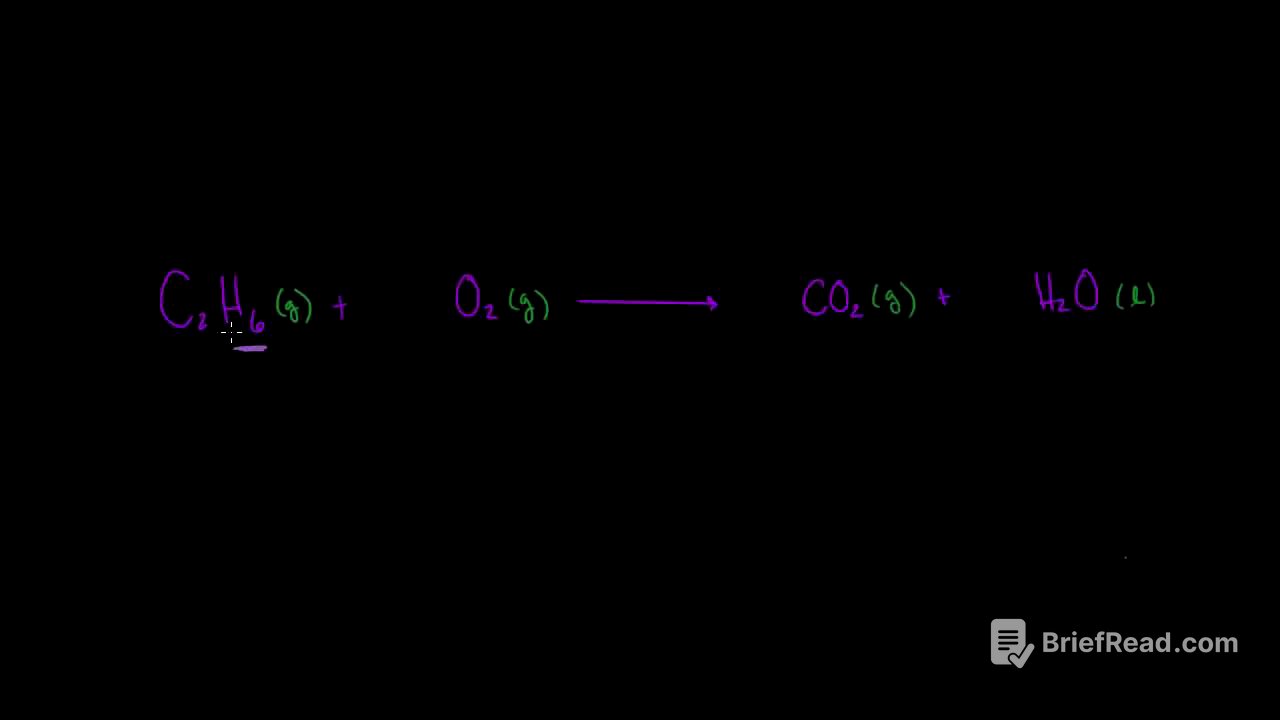Resumen breve
Este video explica cómo balancear la ecuación química para la reacción de combustión del etano (C2H6) con oxígeno (O2) para producir dióxido de carbono (CO2) y agua (H2O). El video muestra paso a paso cómo ajustar los coeficientes de cada molécula para que la ecuación esté balanceada, es decir, que haya el mismo número de átomos de cada elemento en ambos lados de la ecuación.
- Se explica cómo balancear la ecuación paso a paso, comenzando por los átomos de carbono e hidrógeno.
- Se muestra cómo ajustar el coeficiente del oxígeno molecular (O2) al final para obtener una ecuación balanceada.
- Se explica cómo convertir la ecuación balanceada a la forma estándar, donde todos los coeficientes son números enteros.
Balanceando la ecuación de combustión del etano [0:00]
El video comienza con la ecuación química no balanceada para la reacción de combustión del etano: C2H6 + O2 → CO2 + H2O. Se explica que la ecuación no está balanceada porque hay un número diferente de átomos de cada elemento en ambos lados de la ecuación. Por ejemplo, hay dos átomos de carbono en el lado izquierdo y solo uno en el lado derecho.
Para balancear la ecuación, se comienza por ajustar los coeficientes de las moléculas que contienen carbono e hidrógeno. Se explica que es mejor dejar el oxígeno molecular (O2) para el final, ya que se puede ajustar fácilmente sin afectar el número de otros elementos.
Se ajusta el coeficiente del agua (H2O) a 3 para tener seis átomos de hidrógeno en ambos lados de la ecuación. Luego, se ajusta el coeficiente del dióxido de carbono (CO2) a 2 para tener dos átomos de carbono en ambos lados.
Finalmente, se ajusta el coeficiente del oxígeno molecular (O2) a 3.5 para obtener siete átomos de oxígeno en ambos lados de la ecuación. Sin embargo, se explica que esta ecuación no está en la forma estándar, ya que tiene un coeficiente fraccionario.
Para convertir la ecuación a la forma estándar, se multiplica toda la ecuación por 2. Esto da como resultado la siguiente ecuación balanceada: 2C2H6 + 7O2 → 4CO2 + 6H2O.