Resumen Breve
Este video explica qué son los electrones de valencia y por qué son importantes en la química. Se define a los electrones de valencia como aquellos ubicados en el nivel de energía más externo de un átomo y se muestra cómo identificarlos a partir de la configuración electrónica. Además, se introduce el concepto de la estructura de Lewis como una forma sencilla de representar estos electrones. Finalmente, se explica cómo los electrones de valencia influyen en el tamaño de los átomos y en su comportamiento químico, incluyendo la tendencia a completar el octeto para alcanzar la estabilidad electrónica.
- Los electrones de valencia son los electrones en el nivel de energía más externo de un átomo.
- Se pueden identificar a partir de la configuración electrónica del átomo.
- La estructura de Lewis es una representación visual de los electrones de valencia.
- Los electrones de valencia influyen en el tamaño y el comportamiento químico de los átomos.
- Los átomos tienden a completar su octeto de electrones de valencia para lograr estabilidad, similar a los gases nobles.
Intro [0:00]
El video introduce el tema de los electrones de valencia, destacando su importancia para comprender la tabla periódica, los enlaces químicos y las interacciones entre átomos. Se critica la definición simplista de los electrones de valencia como los que están en el nivel más externo, argumentando que esta descripción no transmite su relevancia real. El objetivo del video es proporcionar una comprensión más profunda y completa de este concepto fundamental en la química.
¿Qué son? [0:45]
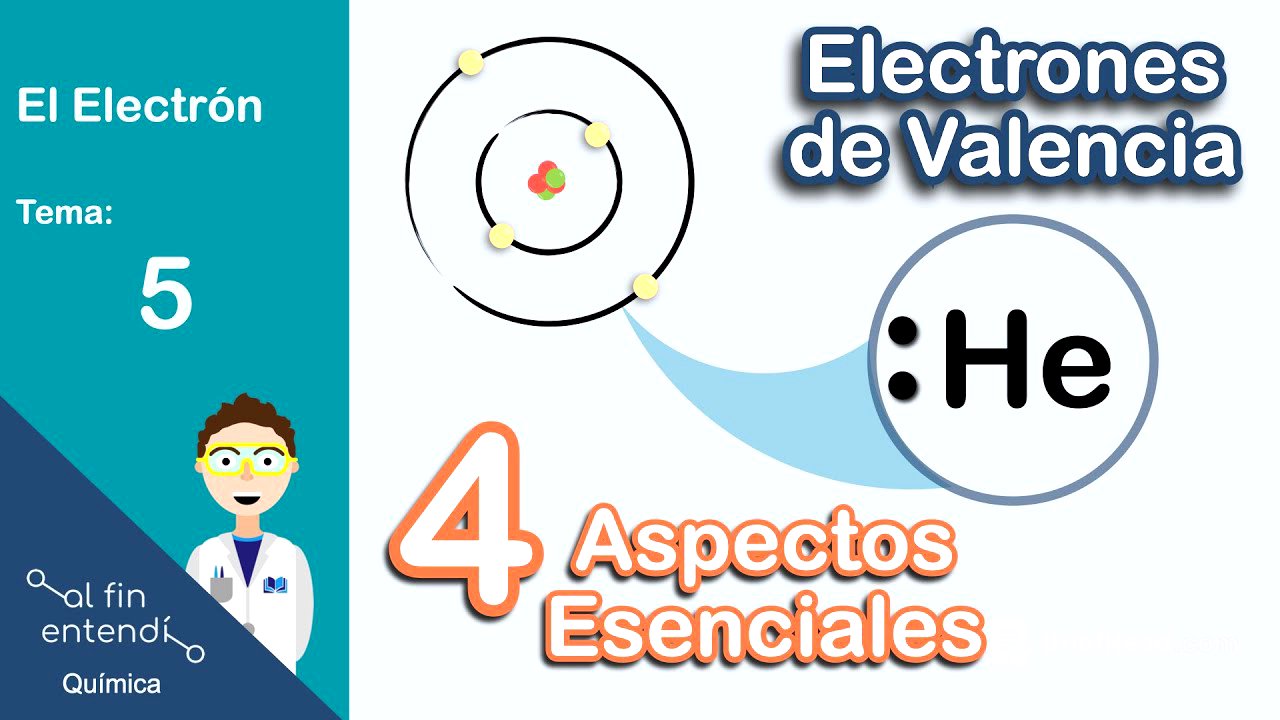
Se define a los electrones de valencia como aquellos que se encuentran en el nivel más externo de un átomo, es decir, los que tienen el valor de "n" (número cuántico principal) más alto. Se explica que si un átomo tiene electrones en los niveles 1, 2 y 3, los electrones de valencia serán solo los que estén en el nivel 3, ya que son los más alejados del núcleo. En el ejemplo dado, se indica que hay 5 electrones de valencia en el nivel 3.
¿Cómo identificarlos? [1:15]
Se explica cómo identificar los electrones de valencia a partir de la configuración electrónica de un átomo. Para ello, se busca el nivel de energía más alto en la configuración electrónica y se cuentan los electrones presentes en ese nivel. Se menciona que la configuración electrónica proporciona información adicional, como la distribución de los electrones de valencia en los orbitales s y p, lo cual es importante en temas más avanzados. Se presenta un ejemplo donde un átomo tiene dos electrones en el nivel 1 y un electrón en el nivel 2, lo que indica que tiene un solo electrón de valencia.
Estructura de Lewis [2:12]
Se introduce la estructura de Lewis como una forma sencilla de representar los electrones de valencia. En esta representación, se escribe el símbolo del elemento y se colocan puntos alrededor para representar los electrones de valencia. Se ejemplifica con el fósforo, que tiene 5 electrones de valencia, por lo que su estructura de Lewis sería el símbolo "P" con cinco puntos alrededor. Luego, se explica cómo dibujar la estructura de Lewis del flúor, para lo cual se necesita conocer su configuración electrónica (1s² 2s² 2p⁵). Se determina que el flúor tiene 7 electrones de valencia, por lo que su estructura de Lewis sería "F" con siete puntos alrededor. Se aclara que las estructuras de Lewis se utilizan comúnmente para los elementos de los grupos representativos.
Importancia [3:40]
Se explica la importancia de los electrones de valencia, mencionando dos ejemplos principales. Primero, influyen en el tamaño de los átomos: un átomo con un electrón de valencia en el nivel 4 será más grande que uno con un electrón de valencia en el nivel 2. Segundo, los electrones de valencia son los primeros en interactuar con otros átomos, lo que da lugar a los enlaces químicos. Se menciona que un enlace químico es la unión entre dos átomos, y esta unión puede ser fuerte o débil dependiendo de la interacción entre los electrones de valencia.
Octeto [4:56]
Se explica cómo los electrones de valencia definen el comportamiento químico de los átomos. Se menciona que la configuración electrónica de los gases nobles es muy estable, ya que tienen 8 electrones de valencia (octeto completo), lo que los hace inertes. Se ejemplifica con el neón y el argón, que tienen 8 electrones de valencia y, por lo tanto, son estables. En contraste, el oxígeno tiene 6 electrones de valencia y es muy reactivo, ya que busca completar su octeto. Se explica que el oxígeno reacciona con otros átomos para conseguir dos electrones más y alcanzar una configuración electrónica similar a la de un gas noble, aunque adquiere una carga negativa (-2) al ganar electrones. Se concluye que los electrones de valencia determinan cómo se comporta un átomo, ya que este reaccionará para completar su octeto y alcanzar estabilidad, adquiriendo una carga positiva o negativa en el proceso. Se ejemplifica con el potasio, que tiene un solo electrón de valencia y tiende a perderlo para alcanzar la configuración electrónica del argón, adquiriendo una carga positiva (+1).