Resumen Breve
Este video compara los puntos de ebullición del propano y el acetaldehído, a pesar de tener masas molares similares. Explica cómo las fuerzas intermoleculares, especialmente las fuerzas dipolo-dipolo, influyen en los puntos de ebullición. El acetaldehído tiene un punto de ebullición más alto debido a su momento dipolar permanente, resultante de la diferencia de electronegatividad entre el carbono y el oxígeno, lo que genera atracciones dipolo-dipolo más fuertes en comparación con las débiles fuerzas de dispersión de London en el propano.
- Las fuerzas intermoleculares determinan el punto de ebullición.
- Los dipolos permanentes crean fuerzas dipolo-dipolo.
- La electronegatividad influye en los momentos dipolares.
Introducción: Propano vs. Acetaldehído [0:00]
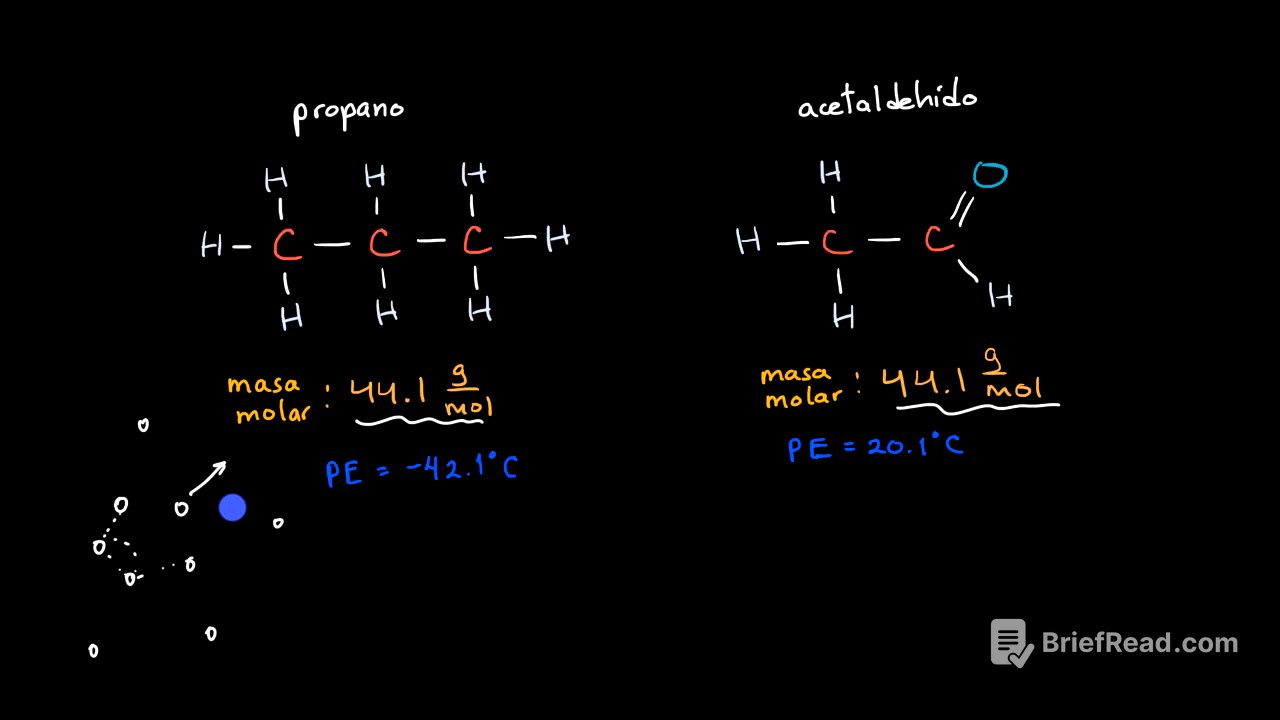
Se comparan las moléculas de propano y acetaldehído, que tienen masas molares muy cercanas, para determinar cuál tiene un punto de ebullición más alto. Se plantea que el punto de ebullición depende de la energía necesaria para superar las fuerzas intermoleculares y permitir que las moléculas pasen al estado gaseoso. La clave para determinar cuál tiene un punto de ebullición más alto radica en identificar cuál tiene las fuerzas intermoleculares más fuertes.
Fuerzas de Dispersión de London y Masa Molar [1:02]
Se discuten las fuerzas de dispersión de London, que surgen de dipolos aleatorios y temporales en las moléculas, capaces de inducir dipolos en moléculas vecinas. Estas fuerzas son más pronunciadas en moléculas más polarizables, lo cual está relacionado con el tamaño de la nube de electrones y, por ende, con la masa molar. Dado que el propano y el acetaldehído tienen masas molares similares, se podría esperar que sus puntos de ebullición también lo sean. Sin embargo, el propano tiene un punto de ebullición de -42.1°C, mientras que el acetaldehído tiene un punto de ebullición de 20.1°C.
Fuerzas Dipolo-Dipolo y Momentos Dipolares [2:21]
Se introduce el concepto de fuerzas dipolo-dipolo como una explicación adicional para las diferencias en los puntos de ebullición. Se explica que estas fuerzas se deben a la atracción entre dipolos permanentes en las moléculas. Se analiza cuál de las dos moléculas tiene un momento dipolar más grande, recordando que los momentos dipolares moleculares son la suma vectorial de los momentos dipolares de los enlaces individuales, los cuales son proporcionales a las diferencias en la electronegatividad.
Análisis del Momento Dipolar en Propano y Acetaldehído [3:00]
Se examina el propano, donde los enlaces carbono-hidrógeno tienen momentos dipolares pequeños debido a la ligera diferencia de electronegatividad. Sin embargo, la simetría de la molécula hace que estos momentos dipolares se cancelen en gran medida, resultando en un momento dipolar molecular pequeño. En contraste, el acetaldehído es una molécula asimétrica con un doble enlace carbono-oxígeno, donde el oxígeno es mucho más electronegativo que el carbono, generando un momento dipolar significativo en este enlace.
Atracción Dipolo-Dipolo en el Acetaldehído [4:32]
Se explica que el momento dipolar significativo en el doble enlace carbono-oxígeno del acetaldehído no se cancela debido a la asimetría de la molécula, resultando en un momento dipolar molecular neto. Esto crea una carga negativa parcial en el extremo del oxígeno y una carga positiva parcial en el extremo del carbono. Como resultado, el extremo negativo de una molécula de acetaldehído es atraído hacia el extremo positivo de otra, generando fuerzas dipolo-dipolo.
Conclusión: Fuerzas Intermoleculares y Puntos de Ebullición [5:20]
Se concluye que el acetaldehído experimenta fuerzas dipolo-dipolo además de las fuerzas de dispersión de London, lo que explica su punto de ebullición más alto en comparación con el propano. Se menciona que un dipolo permanente puede inducir un dipolo en una molécula vecina, generando una interacción dipolo inducida. Se resume que las interacciones pueden ser entre dipolos temporales (dispersión de London), dipolos permanentes (dipolo-dipolo) o un dipolo permanente que induce un dipolo en una molécula vecina.