Résumé
Ce cours porte sur la spectroscopie infrarouge (IR), une technique d'analyse qui utilise l'absorption de la lumière infrarouge par les molécules pour identifier leurs composants et structures. Contrairement à la spectroscopie UV-visible, l'IR excite les vibrations moléculaires plutôt que les électrons. Le spectre IR est divisé en deux régions : l'empreinte digitale (moins de 1500 cm-1) rarement analysée, et la région fonctionnelle (plus de 1500 cm-1) où les groupements fonctionnels sont identifiés. L'interprétation des spectres IR nécessite l'utilisation de tables de données pour corréler les nombres d'ondes aux liaisons spécifiques.
- La spectroscopie infrarouge (IR) est une technique d'analyse qui utilise l'absorption de la lumière infrarouge par les molécules pour identifier leurs composants et structures.
- Le spectre IR est divisé en deux régions : l'empreinte digitale et la région fonctionnelle.
- L'interprétation des spectres IR nécessite l'utilisation de tables de données pour corréler les nombres d'ondes aux liaisons spécifiques.
Introduction à la spectroscopie infrarouge [0:00]
La spectroscopie infrarouge (IR) est une technique qui consiste à envoyer des ondes électromagnétiques sur des molécules et à observer les ondes absorbées. La lumière infrarouge, moins énergétique que la lumière UV ou visible, provoque des vibrations et des rotations des liaisons entre les atomes, plutôt que des transitions électroniques. Le principe de mesure est similaire à celui de la spectroscopie UV-visible, mais l'appareil est différent. On mesure la transmittance en pourcentage ou l'absorbance, et on utilise le nombre d'ondes (cm-1), inverse de la longueur d'onde, au lieu de la longueur d'onde elle-même. L'axe des abscisses est orienté de la droite vers la gauche.
Interprétation du spectre infrarouge [1:51]
Le spectre infrarouge est divisé en deux parties : une première partie pour les nombres d'ondes inférieurs à 1500 cm-1, appelée "empreinte digitale", rarement analysée, et une deuxième partie supérieure à 1500 cm-1, où l'on repère les différentes absorbances. Par exemple, une absorbance vers 2800-3000 cm-1 correspond aux liaisons entre les atomes de carbone et d'hydrogène, tandis qu'une absorbance plus large correspond aux liaisons OH avec des liaisons hydrogène. L'interprétation nécessite l'utilisation d'une table de données référençant les liaisons caractéristiques et leurs nombres d'ondes correspondants.
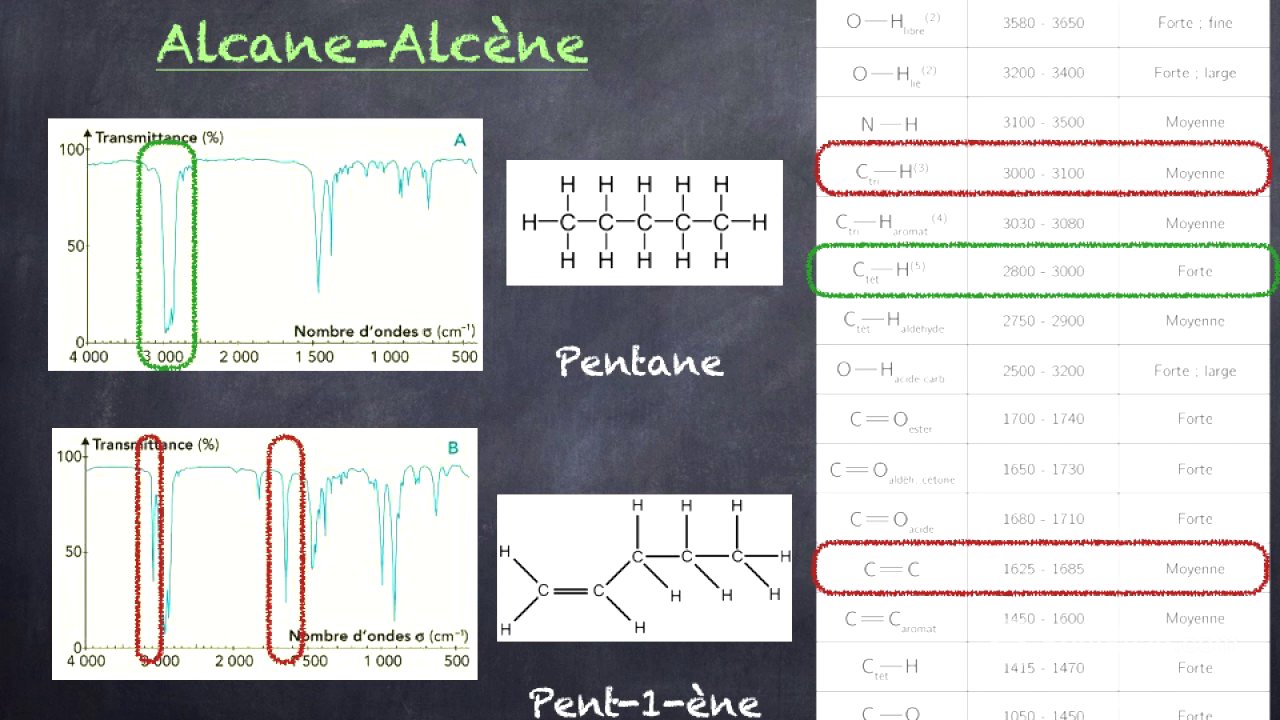
Spectres IR des alcanes et des alcènes [3:07]
Un alcane, constitué uniquement d'atomes de carbone et d'hydrogène, présente une liaison carbone-hydrogène sur le spectre infrarouge entre 2800 et 3000 cm-1. Un alcène se différencie par la présence d'une double liaison carbone-carbone. Sur le spectre, on repère toujours les liaisons carbone-hydrogène, mais on observe en plus un petit pic vers 3000-3100 cm-1 pour les liaisons carbone-hydrogène de la double liaison carbone-carbone, ainsi que la double liaison carbone-carbone vers 1625-1665 cm-1.
Spectre IR des alcools [4:18]
Sur le spectre d'un alcool, une bande caractéristique est observée vers 3200-3400 cm-1, correspondant à la liaison OH. Il existe deux types de liaisons OH : les liaisons OH liées et les liaisons OH libres. La différence réside dans la présence de liaisons hydrogène entre les molécules d'alcool. Les liaisons OH liées sont présentes lorsqu'il y a des liaisons hydrogène entre les molécules d'alcool, ce qui se produit dans un alcool pur ou fortement concentré. Les liaisons OH libres apparaissent lorsqu'il n'y a pas de liaisons hydrogène, comme dans un alcool très dilué.
Spectre IR des cétones et des aldéhydes [6:06]
Pour les cétones, caractérisées par un groupe carbonyle, on observe la présence de la bande caractéristique des liaisons CH et une bande forte vers 1700 cm-1, correspondant à la double liaison CO. Les aldéhydes, qui se différencient des cétones par la position du groupe carbonyle en fin de chaîne, présentent également les liaisons CH, un petit pic vers 2750-2900 cm-1 caractéristique de la liaison CH liée au groupe carbonyle, et la bande caractéristique de la double liaison CO.
Spectre IR des acides carboxyliques [7:15]
Pour les acides carboxyliques, dont le groupe fonctionnel caractéristique est le groupe carboxyle (double liaison CO et groupe hydroxyle OH), on observe une bande relativement large vers 3000 cm-1, qui est la superposition des bandes correspondant à la liaison CH et à la liaison OH, ainsi que la bande caractéristique de la double liaison CO vers 1700 cm-1.
Spectre IR des amines et des amides [7:58]
Pour les amines, on retrouve la bande caractéristique des liaisons CH entre 2800 et 3000 cm-1, ainsi qu'une bande supplémentaire entre 3100 et 3500 cm-1, caractéristique des liaisons NH. Pour les amides, on observe la bande caractéristique des liaisons NH et une bande entre 1600 et 1700 cm-1, caractéristique de la double liaison CO, reflétant le groupe fonctionnel amide.
Spectre IR des esters [8:58]
Pour les esters, on peut observer une bande caractéristique vers 1750 cm-1, qui correspond à la double liaison CO. Il est important de lire les nombres d'ondes avec précision, car cela permet de distinguer si la double liaison fait partie d'un acide, d'un aldéhyde, d'une cétone ou d'un ester.
Exercice d'identification de molécule [9:42]
Un exercice est proposé pour identifier une molécule à partir de son spectre IR. En observant une bande caractéristique entre 3200 et 3400 cm-1, correspondant aux liaisons OH liées, on peut éliminer certaines options. La présence d'une bande vers 1650 cm-1, potentiellement une double liaison carbone-carbone ou une double liaison CO, nécessite une analyse plus précise. Un indice supplémentaire est la présence d'un petit pic vers 3000-3100 cm-1 pour les liaisons CH d'une double liaison carbone-carbone. En identifiant les liaisons OH et la double liaison carbone-carbone, on peut déterminer qu'il s'agit de la molécule M.