Breve Resumen
Este video explica la estructura de las proteínas, desde su composición básica de aminoácidos hasta sus niveles de organización tridimensional. Se discuten los enlaces peptídicos, las fuerzas que influyen en el plegamiento proteico (enlaces de hidrógeno, atracciones electrostáticas, fuerzas de Van der Waals e interacciones hidrófobas), los patrones de plegamiento regulares (hélice alfa y lámina beta), y los niveles de estructura proteica (primaria, secundaria, terciaria y cuaternaria). También se menciona el papel de las chaperonas moleculares en el plegamiento correcto de las proteínas y la importancia de los sitios de unión.
- Las proteínas están formadas por aminoácidos unidos por enlaces peptídicos.
- El plegamiento de las proteínas está influenciado por diversas fuerzas, incluyendo enlaces no covalentes e interacciones hidrófobas.
- Las proteínas tienen cuatro niveles de estructura: primaria, secundaria, terciaria y cuaternaria.
Introducción a las Proteínas y los Aminoácidos [0:00]
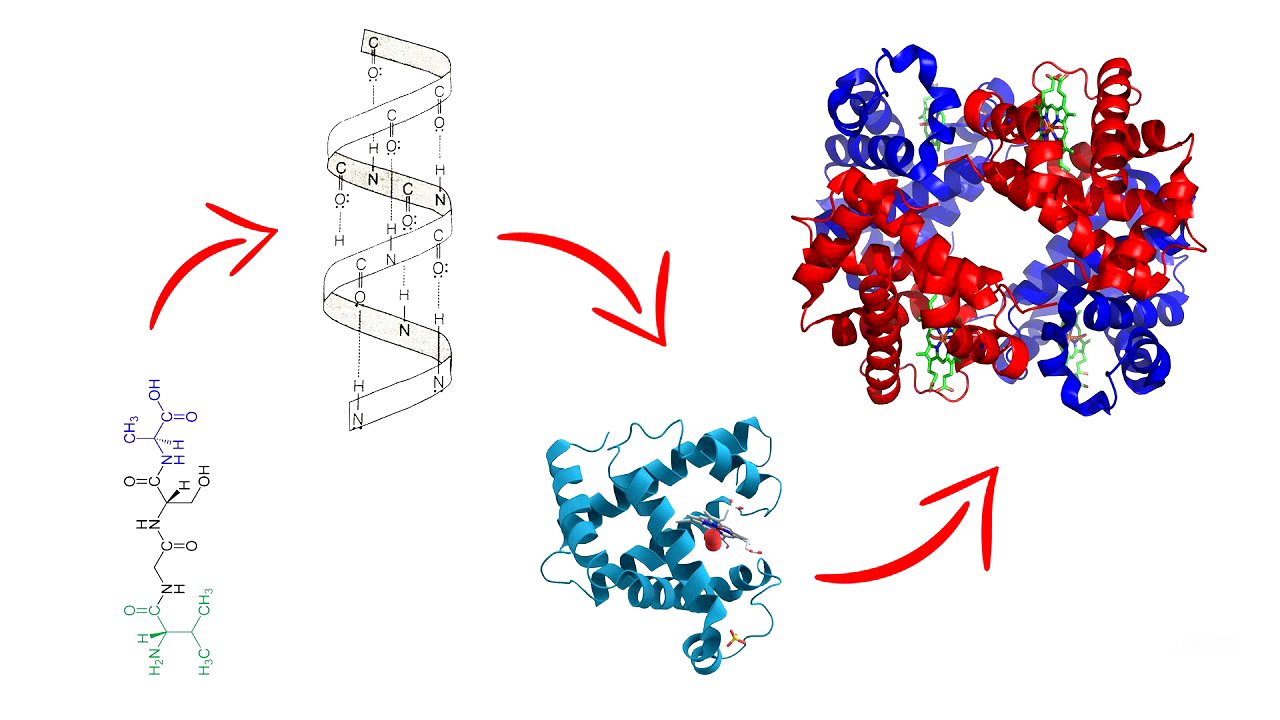
Las proteínas son macromoléculas esenciales para la vida, ya que son los componentes básicos de las células y desempeñan una gran variedad de funciones. Están formadas por la unión de aminoácidos a través de enlaces peptídicos, formando cadenas polipeptídicas o polipéptidos. La secuencia de aminoácidos en una proteína es específica y determina su función. Todos los aminoácidos comparten una estructura base común, pero se diferencian por su radical, que es lo que les confiere sus propiedades únicas.
El Esqueleto Polipeptídico y las Cadenas Laterales [0:57]
En una cadena polipeptídica, la estructura central compartida por todos los aminoácidos se conoce como esqueleto polipeptídico, mientras que los radicales que se proyectan hacia el exterior se denominan cadenas laterales. Estas cadenas laterales son las que interactúan entre sí y con el entorno, influyendo en el plegamiento y la función de la proteína.
Plegamiento de las Proteínas y Fuerzas Involucradas [1:11]
Las cadenas polipeptídicas no son simplemente lineales, sino que se pliegan y rotan sobre sí mismas para formar estructuras tridimensionales complejas. Este plegamiento está influenciado por varias fuerzas, incluyendo enlaces de hidrógeno, atracciones electrostáticas, fuerzas de Van der Waals e interacciones hidrófobas. Los aminoácidos se clasifican como polares (hidrófilos) o no polares (hidrófobos), y su distribución en la cadena polipeptídica contribuye al plegamiento de la proteína.
Conformación Estable y Plegamiento Incorrecto [2:15]
Cada proteína se pliega normalmente en una única conformación estable, aunque esta conformación puede cambiar ligeramente cuando la proteína interactúa con otras moléculas de la célula. Sin embargo, en algunos casos, las proteínas pueden plegarse incorrectamente, formando agregados que dañan las células y los tejidos. Estos agregados proteicos están implicados en enfermedades neurodegenerativas como el Alzheimer y la enfermedad de Huntington.
Chaperonas Moleculares y Diversidad Estructural [2:43]
Aunque las proteínas pueden plegarse correctamente sin ayuda externa, en la célula viva este proceso es asistido por proteínas especiales llamadas chaperonas moleculares. Estas chaperonas ayudan a que las cadenas polipeptídicas recién sintetizadas se asocien de forma correcta, haciendo que el plegamiento sea más eficiente y fiable. Las proteínas varían mucho en tamaño y forma, pudiendo ser globulares o fibrosas, y formar filamentos, láminas, anillos o esferas.
Patrones de Plegamiento Regular: Hélice Alfa y Lámina Beta [3:16]
A pesar de la variabilidad en el plegamiento de las proteínas, suelen presentarse dos patrones de plegamiento regular: la hélice alfa y la lámina beta. Estos patrones son comunes porque resultan de los enlaces de hidrógeno que se forman entre el grupo amino y el grupo carboxilo del esqueleto polipeptídico, presentes en muchas secuencias de aminoácidos.
Niveles de Organización de las Proteínas [3:38]
Las proteínas tienen varios niveles de organización: primaria, secundaria, terciaria y cuaternaria. La estructura primaria es simplemente la secuencia de aminoácidos. La estructura secundaria se refiere a la formación de hélices alfa y láminas beta dentro de ciertos segmentos de la cadena polipeptídica. La estructura terciaria es la formación tridimensional completa de la proteína, incluyendo hélices alfa, láminas beta, espirales aleatorios y bucles. La estructura cuaternaria se refiere a la formación de un complejo proteico a partir de múltiples cadenas polipeptídicas.
Sitios de Unión y Familias de Proteínas [4:26]
Las proteínas tienen regiones específicas llamadas sitios de unión, donde pueden establecer enlaces no covalentes con otras moléculas, incluyendo otras proteínas. Las proteínas se pueden agrupar en familias, donde los miembros comparten una secuencia de aminoácidos y una conformación tridimensional similar.